Matière atome et molécule
La matière (de mater qui signifie mère) est présente autour de nous sous trois formes ou plus exactement trois états : solide, liquide et gazeux. Une substance comme l'eau pourra être de la glace, du liquide incolore ou de la vapeur d'eau selon la température et la pression exercée sur cette eau.
Mais sous n'importe quelle forme que ce soit l'eau est formée par les mêmes atomes et c'est l'organisation de ces atomes et molécules qui donnerons à l'eau sa forme solide (glace), sa forme liquide (incolore) ou sa forme gazeuse (vapeur invisible).

Organisation de la matière
Corps composés et corps simples
Les travaux des chimistes ont montrés que la matière pouvait se diviser en un certain nombre de corps simples purs (exemples : le fer, le cuivre, le sodium, l'oxygène, l'hydrogène…).
Ces corps simples peuvent s'unir entre eux pour former d'autres corps purs : ce sont les corps composés ou combinaisons.
De nombreux corps composés se trouvent dans la nature (exemples : le chlorure de sodium ou sel de cuisine, le carbonate de calcium ou marbre…).
Un corps composé est toujours constitué par les mêmes corps simples et dans les mêmes proportions.
La molécule
Molécule vient du latin môle qui signifie masse.
La molécule est la plus petite partie d'un corps pur susceptible d'exister à l'état isolé en gardant les caractères de ce corps.
Une molécule est formée d'atomes ;
dans un corps simple, elle est formée d'un ou plusieurs atomes semblables,
dans un corps composé, elle est formée d'atomes différents.
Atome
L'atome est la plus petite partie d'un élément chimique à l'état électrique neutre. Il est susceptible d'entrer dans les combinaisons chimiques avec d'autres atomes pour constituer des molécules.
L'atome est constitué d'un noyau atomique (protons, neutrons) autour duquel gravitent des électrons répartis sur une ou plusieurs orbites ou couches.
La molécule d'eau (H2O) contient 2 atomes d'hydrogène et 1 atome d'oxygène.
Le mot atome vient du grec « impossible à diviser », de a- → "anti" ,"impossible" et -tome → "temnein" ; "couper"}
Particules élémentaires
{Particule : très petite partie}
{Élémentaire : simple}
électron : particule élémentaire contenant la plus petite charge d'électricité négative. Sa masse au repos est égale à la 1836 ème partie de celle de l'atome d'hydrogène.
- Charge de l'électron : 1,6·10-19 Coulomb (charge élémentaire ⇒ e).
- Masse de l'électron : 9,10938·10-31 Kilogramme.
Proton : particule élémentaire contenant la plus petite charge d'électricité positive.
Neutron : particule élémentaire électriquement neutre dont la masse est sensiblement égale à celle du proton.
Le noyau atomique chargé positivement contient presque toute la masse de l'atome. Il est constitué par la réunion de protons et neutrons sauf pour l'hydrogène dont le noyau se réduit à un proton. L'atome est électriquement neutre puisqu'il a autant de charges positives (les protons) que de charges négatives (les électrons) et que ces charges de sens contraires s'attirent.
Le diamètre d'un atome est compris entre 0,1 et 0,4 millimicron.
L'atome d'hydrogène est le plus simple de tous :
Atome d'hydrogène
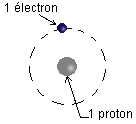
1 proton
1 électron
Atome d'oxygène
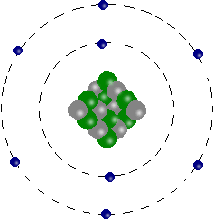
Il est constitué de 8 électrons,
8 protons
et 8 neutrons.
16 est le nombre de masse (8 protons + 8 neutrons).
Le nombre de masse correspond au nombre total de protons et de neutrons constituant le noyau atomique.
Relation entre l'atome et l'électricité
Couche électronique
Les électrons qui gravitent autour du noyau sont répartis sur plusieurs couches en fonction de leur niveau énergétique.
Les électrons périphériques appartiennent normalement à la couche électronique externe qui intervient dans les phénomènes lumineux, dans les phénomènes de conduction, ainsi que dans les propriétés chimiques de l'atome.
La couche externe ne peut contenir plus de 8 électrons.
On peut classer les atomes à partir de cette couche :
Les atomes ayant 1, 2 ou 3 électrons sur la couche périphérique ont tendance à les perdre.
Les électrons deviennent libres. C'est le cas des bons conducteurs électriques.
Les atomes ayant 5, 6 ou 7 électrons sur cette couche ont tendance à compléter cette dernière à 8.
C'est le cas des isolants.
Les atomes ayant 4 électrons constituent la catégorie des semi-conducteurs.
Les atomes ayant 8 électrons périphériques n'ont aucune tendance. Ce sont les gaz rares.
Ions positifs, ions négatifs
Les électrons n'étant pas disposés sur une même orbite, nous concevons bien que les électrons les plus éloignés soient moins attirés par le noyau, donc plus faciles à soustraire à son attraction.
Si un électron quitte l'atome, l'équilibre de celui-ci est rompu. Un ion est donc un atome ou groupe d'atomes
possédant une charge électrique totale non nulle.
En effet, si un atome perd ou capture un ou plusieurs électrons, la charge positive du noyau n'est plus entièrement neutralisée.
L'atome incomplet devient suivant le cas un ion positif ou un ion négatif.
Classification périodique
Elle est due au chimiste russe Mendeleïev qui la publia en 1870. Les éléments sont placés les uns à la suite des autres, le numéro atomique augmentant chaque fois d'une unité. On revient à la ligne chaque fois que commence une nouvelle couche électronique.
Les éléments d'une même colonne appartiennent à la même famille chimique et ont des propriétés voisines.
Liaisons entre atomes
Liaison ionique
Elle fait intervenir l'électrovalence correspondant à un gain ou une perte d'électron. Les ions ne sont pas liés (inexistence de la molécule à composé ionique). L'édifice est le résultat d'un équilibre entre les forces d'attraction et de répulsion électrostatique. C'est le cas des sels tel que le chlorure de sodium. 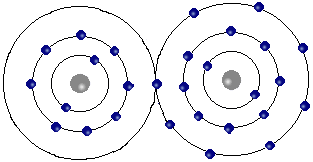
Liaison ionique : Chlorure de sodium Na Cl.
Liaison covalente
Elle fait intervenir la mise en commun d'électrons entre les atomes. On obtient un véritable lien entre atomes (existence de la molécule). 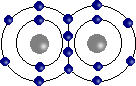 Molécule d'oxygène O2.
Molécule d'oxygène O2.
Dans les deux cas, les atomes tendent à avoir leur couche électronique externe complète (généralement 8 électrons).
Les liaisons covalentes sont toujours plus difficiles à rompre que les liaisons électrovalentes.
Cristaux
Un certain nombre de corps solides, en particulier les métaux, cristallisent, c'est à dire que les atomes sont rangés suivant un motif géométrique régulier (maille) qui se répète pour former un cristal.
Le motif et les dimensions des mailles permettent d'expliquer un certain nombre de propriétés physiques des corps correspondants.
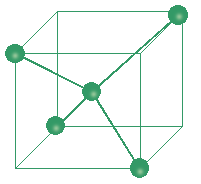
Les figures ci dessus montrent la disposition des atomes de carbone dans les cristaux de diamant et graphite.
La différence de dureté en particulier est la conséquence de la nature cristalline, ainsi que la différence de conductivité (diamant isolant, graphite conducteur).
(1)
 (2)
(2)
(1) = Maille élémentaire du réseau cristallin du diamant
(2) = Maille élémentaire du réseau cristallin du graphite
Définitions
Valence : c'est le nombre de liaisons chimiques qu'un atome peut avoir avec les atomes d'autres substances, dans une combinaison.
Nombre atomique : indique le nombre d'électrons, ou encore le nombre de protons du noyau.
Exercices
Exercice 1
La molécule d'eau est formée ainsi : H2O.
Donner le détail des atomes qui composent cette molécule.
Exercice 2
Le numéro atomique du cuivre (Cu) est 29.
Quel est le nombre d'électrons qui gravitent autour du noyau ?
De combien de protons et neutrons est constitué le noyau ?
Quelle est le nombre de masse de ce noyau ?
Exercice 3
Le calcium est un élément chimique (métal) et son symbole est Ca.
Que représente alors le Ca2+ ?
